- les insectes ravageurs agricoles et forestiers (pucerons, charançons, pyrales, criquets)
- les insectes vecteurs de maladies (moustiques, mouches, simulies)
- les ectoparasites de vertébrés (puces, poux)
- divers insectes indésirables qui envahissent les habitations (blattes, mouches, fourmis, punaises de lit) ou détériorent les matériaux comme le bois (termites, fourmis charpentières).
Les insecticides sont généralement actifs contre d’autres arthropodes comme les acariens (tétranyques, tiques) et certains crustacés (copépodes). Certains d'entre eux agissent aussi contre des organismes plus éloignés phylogénétiquement comme les vers nématodes ou certains mollusques (limaces, escargots). Les insecticides représentent près du quart du marché mondial des pesticides et plus de la moitié des pesticides utilisés dans les régions tropicales d’Afrique et d’Asie.
La très grande majorité des insecticides commercialisés sont des neurotoxiques synthétiques qui perturbent le fonctionnement du système nerveux central et périphérique des insectes, entraînant leur paralysie ou hyperexcitation puis leur mort. Au niveau moléculaire, les cibles peuvent être des canaux ioniques, des enzymes ou encore des neuromédiateurs. En raison de leur mode d’action neurotoxique, ils sont assez peu sélectifs, et de ce fait, généralement toxiques pour de nombreuses espèces animales y compris les insectes auxiliaires de la lutte biologique, les pollinisateurs, les organismes aquatiques et les vertébrés dont les humains.
 |
| Les principaux insecticides neurotoxiques perturbent la conduction de l'influx nerveux soit au niveau de la membrane neuronale (DDT, pyréthrinoîdes) soit au niveau des jonctions entre deux neurones ou synapses (cyclodiènes, lindane, organophosphorés, carbamates). Crédit : USDA Forest Service - Region 8 - Southern , USDA Forest Service, Bugwood.org |
De plus, les insecticides neurotoxiques induisent très souvent des résistances chez les insectes visés par une modification de leur cible moléculaire ou par une amplification de leur dégradation enzymatique. À ce jour, on dénombre plus de 600 espèces d’insectes ravageurs ou vecteurs qui ont développé une résistance à un ou plusieurs insecticides. Certaines espèces comme le doryphore de la pomme de terre ont développé des résistances multiples à presque tous les insecticides connus.
Les insecticides peuvent aussi agir spécifiquement contre les œufs (ovicides), les larves (larvicides) ou les adultes (adulticides) ou, le plus souvent, contre tous les stades de développement de l’insecte.
Ils peuvent pénétrer dans l’insecte de trois façons différentes :
- par contact (à travers sa cuticule)
- par ingestion (voie digestive)
- par inhalation (fumigation)
Modes d'action des principales familles d'insecticides
Insecticides neurotoxiques
| |
Modulateurs du canal sodium dépendant du potentiel (axones)
|
Certains organochlorés (diphényléthanes et DDT)
Pyrétrines naturelles et pyréthrinoïdes synthétiques Oxadiazines (indoxacarbe) |
Inhibiteurs de l’acétylcholine estérase AchE
|
Organophosphorés
Carbamates |
Agonistes du récepteur cholinergique nicotinique nAChR (synapses)
|
Nicotine
Néonicotinoïdes Sulfoximines (sulfoxaflor) Spinosynes |
Bloqueurs du canal chlore associé au récepteur GABA (synapses)
|
Certains organochlorés (cyclodiènes, lindane)
Phénylpyrazoles (fipronil) |
Activateurs du canal chlore glutamate dépendant GluC
|
Avermectines naturelles et synthétiques
|
Antagonistes des récepteurs de l’octopamine
|
Formamidines
|
Insecticides régulateurs de croissance
| |
Inhibiteurs de la biosynthèse de la chitine
|
Benzoylurées
|
Mimétiques des hormones juvéniles
|
Sesquiterpènoïdes
Carbamates non neurotoxiques (fénoxycarbe) |
Agonistes de l’ecdysone
|
Benzhydrazides
Diacylhydrazines |
Autres insecticides
| |
Inhibiteurs de la respiration mitochondriale (plusieurs cibles moléculaires)
|
Roténone
Chlorfénapyr Phosphine Cyanure d’hydrogène |
Perturbateurs de la membrane intestinale
|
Endotoxines Cry et Cyt de Bacillus thuringiensis (Bt)
|
Modulateurs des canaux calciques RyR (muscles)
|
Ryanodine
Diamides |
Les insecticides sont les pesticides les plus nombreux et les plus diversifiés. On dénombre plus de 600 molécules actives appartenant à diverses familles chimiques (Alan Wood, Copendium of Pesticide Common Names) et plusieurs milliers de formulations commerciales. Par commodité, on peut classer les insecticides en cinq grandes catégories :
- Insecticides neurotoxiques de synthèse
- Insecticides régulateurs de croissance
- Toxines bactériennes insecticides
- Insecticides phytochimiques
- Insecticides inorganiques et minéraux
Parmi les principaux autres moyens de lutte contre les insectes nuisibles ou indésirables, on peut citer :
- la lutte biologique au moyen de prédateurs entomophages ou d'insectes parasitoïdes (faune auxiliaire)
- les biopesticides à base de bactéries, champignons ou virus entomopathogènes (lutte microbiologique)
- les plantes attractives et les plantes répulsives (flore auxiliaire)
- les répulsifs (insectifuges) et les anti-appétants
- les phéromones d'insecte (lutte sémiochimique)
- les plantes génétiquement modifiées (PGM) pour produire des molécules insecticides
Insecticides neurotoxiques de synthèse
- les organochlorés
- les organophosphorés
- les carbamates insecticides
- les pyréthrinoïdes
- les néonicotinoïdes
Organochlorés
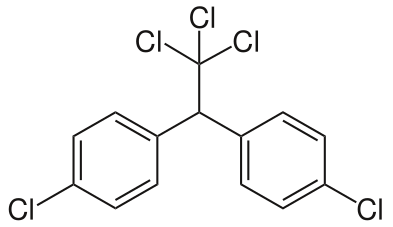
Les organochlorés sont parmi les plus anciens pesticides organiques de synthèse à avoir été commercialisés et utilisés. Ils ont occupé une place majeure dans la lutte antivectorielle et la lutte contre les ravageurs agricoles et forestiers dans les années 1950-1970. Dérivés d’hydrocarbures chlorés, ils sont répartis en trois principaux groupes :- le groupe des diphényles aromatiques qui comprend le DDT (DichloroDiphénylTrichloroéthane) et ses analogues (DichloroDiphényDichloroéthane ou DDD, métoxychlore, camphéchlore ou toxaphène)
- le groupe du lindane (gamma-hexachlorocyclohexane ou HCH)
- le groupe des cyclodiènes (aldrine, chlordane, chlordécone, dieldrine, endosulfan, heptachlore)
Le plus connu d’entre eux, le DDT perturbe la conduction de l’influx nerveux le long des axones en maintenant ouverts les canaux sodium, ce qui provoque des convulsions puis la mort de l’insecte. Le lindane et les cyclodiènes, quant à eux, bloquent l’ouverture des canaux chlore qui sont associés aux récepteurs de l’acide gamma-aminobutyrique (GABA), un neuromédiateur inhibiteur, au niveau des terminaisons neuronales (synapses). Les organochlorés agissent sur l’insecte par contact ou par ingestion sans pénétrer dans la plante.
Leur toxicité aiguë pour l'Homme est faible. Toutefois, lipophiles et peu biodégradables, ils sont très persistants dans l’environnement et s’accumulent dans les tissus adipeux des animaux en bout de chaîne alimentaire par bioaccumulation. Ce sont des polluants organiques persistants (POP) qui peuvent en outre être déplacés sur de très grandes distances par les courants atmosphériques. Bien qu’interdits dans les pays industrialisés depuis plusieurs décennies, on en trouve encore dans l’environnement (sols, sédiments, milieux aquatiques, glaces polaires), les organismes vivants (graisses animales, lait maternel).
De plus, les organochlorés sont tous reconnus comme perturbateurs endocriniens. Six d’entre eux sont interdits d’utilisation à l’échelle mondiale par la Convention internationale de Stockholm sur les polluants organiques persistants (chlordane, dieldrine, endrine, heptachlore, hexachlorobenzène, toxaphène).
L’utilisation du chlordécone jusque dans les années 1993 dans les Antilles françaises pour lutter contre le charançon du bananier est à l’origine de graves pollutions des sols, des nappes phréatiques, des eaux côtières et des aliments entraînant des risques pour l’environnement et la santé publique. En 2013, les sols étaient toujours contaminés et de nombreux légumes restaient impropres à la consommation (Chlordecone-infos, Observatoire des Résidus de Pesticides).
Bannis à l’échelle mondiale, les organochlorés ne sont désormais pratiquement plus utilisés à l’exception de quelques acaricides mais aussi du DDT qui est encore pulvérisé sur les moustiquaires dans les pays en voie de développement. Cette utilisation du DDT recommandée par l’OMS a suscité de vives polémiques (PestInfos, 2006).
Structure chimique du DDT (p,p'-dichlorodiphényltrichloroéthane) Crédit :Leyo, sous licence public via Wikimedia Commons
 |
| En 1945, en Italie, un soldat américain pulvérise du DDT, dilué à 10 % dans du kérosène, dans une maison pour lutter contre la malaria. Crédit photo : Archives of National Museum of Health & Medecine, sous licence CC BY 2.0
De la lutte antipaludique au «Printemps silencieux»...
Le DDT été le premier pesticide de synthèse à être utilisé massivement en santé humaine et en agriculture. Selon certaines estimations, plus de 4 millions de tonnes de DDT ont ainsi été pulvérisées à travers le monde. S’il a permis, entre autre, de maîtriser plusieurs maladies vectorielles comme la malaria et le typhus, son utilisation massive est aussi à l’origine des premiers cas de résistance chez les insectes ciblés et d'une première prise de conscience mondiale des effets néfastes des pesticides sur l’environnement. En 1970, Rachel Carson publie le Printemps silencieux qui met en évidence l'effet du DDT sur la faune aviaire et conduira à son interdiction aux Étas-Unis (PestInfos, L’histoire controversée du DDT). |
Organophosphorés
Dérivés d’esters de l’acide phosphorique, les organophosphorés ont été développés dès la seconde Guerre mondiale, à la faveur de recherches sur les gaz neurotoxiques de combat comme le gaz sarin. On en distingue trois principaux groupes selon leur structure chimique :- les organophosphorés à chaines aliphatiques (malathion, dichlorvos, déméton, diméthoate)
- les organophosphorés à cycle phényl (parathion, bromophos, téméphos)
- les organophosphorés hétérocycliques (chlorpyrifos, diazinon)
Très peu sélectifs, les organophosphorés sont hautement toxiques pour les humains, les animaux vertébrés (poissons, amphibiens, oiseaux), les abeilles et les insectes auxiliaires de la lutte biologique. Toutefois, contrairement aux organochlorés, ils sont très instables, peu persistants et sont donc rapidement dégradés dans l’environnement. De ce fait, bon nombre d’entre eux sont toujours utilisés en agriculture sur les cultures vivrières, les arbres fruitiers et la vigne, en médecine vétérinaire et en lutte antivectorielle.
Par exemple, le malathion est couramment utilisé en lutte antivectorielle contre les moustiques vecteurs du virus du Nil Occidental (VNO) et du Chikungunya mais aussi en médecine contre les poux et la galle. Toutefois, il a été récemment classé comme cancérigène probable par l’OMS. Par ailleurs, le diméthoate qui est très utilisé, entre autres, contre les larves de la mouche Drosophila susuki sur les cerises a été retiré du marché français en 2016 en raison de sa nocivité pour les humains, les oiseaux et la faune du sol.
Le chlorpyrifos-éthyl est un des insecticides les plus communs en Amérique du Nord pour lutter contre les pucerons et chenilles dans les cultures de colza (canola) et les vergers. Aux États-Unis, son usage domestique dans les bâtiments et sur les animaux a été interdit en 2001 en raison de nombreuses intoxications. Son exposition pendant la grossesse peut nuire au développement du cerveau des enfants et causer des troubles neurologiques graves, notamment de la mémoire chez les jeunes garçons (Rauh VA. et al, PNAS 2012; Israel B., Scientific American 2012). Par ailleurs, selon une étude néozélandaise, le chlorpyrifos-éthyl altère la mémoire olfactive des abeilles domestiques, même à très faibles doses (Urlacher E. et al., J Chem Ecol 2016).
Carbamates insecticides
Dérivés de l’acide carbamique (NH2COOH), les carbamates sont apparus dans les années 1930 et ont été très utilisés à partir des années 1950. Tout comme les organophosphorés, ce sont des insecticides neurotoxiques qui inhibent l’acétylcholinestérase (AchE) et, de ce fait, interrompent la conduction de l’influx nerveux. Toutefois, l’inhibition de l’AChE peut être réversible en quelques minutes dans certains cas.On en distingue trois principaux groupes chimiques :
- les carbamates à chaîne aliphatique (aldicarbe, méthomyl)
- les carbamates carbocycliques (carbaryl, propoxur)
- les carbamates hétérocycliques (carbofuran, pirimicarbe)
Les carbamates insecticides peuvent agir de plusieurs façons par contact ou par ingestion; certains d’entre eux comme le méthomyl ou le pirimicarbe sont aussi systémiques et fumigants. De moins en moins nombreux en Europe, les carbamates sont encore assez utilisés à l’échelle mondiale sur une grande diversité de cultures (céréales, arbres fruitiers, légumes). Par exemple, le pirimicarbe, qui est systémique, est largement employé pour lutter contre les pucerons, notamment en raison de sa relative innocuité pour les coccinelles qui sont leurs prédateurs naturels. Peu sélectifs, certains carbamates servent aussi comme hélicides (méthiocarbe) ou comme nématicides (aldicarbe).
Peu rémanents dans les sols, les carbamates sont plus stables dans l’eau. Très peu sélectifs, ils sont toxiques pour les poissons, les oiseaux, les abeilles et la microflore du sol.
| La catastrophe de Bhopal Le carbaryl comme l’aldicarbe, le carbofuran ou le méthomyl sont synthétisés à partir d’isocyanate de méthyle (CH3-N=C=O), un produit chimique extrêmement dangereux, toxique et irritant. Ce dernier est à l’origine de la catastrophe de Bophal (Inde) en décembre 1984, un des pires accidents industriels de l’histoire. L’explosion dans une usine agrochimique d’Union Carbide, qui produisait entre autres du carbaryl (sous la marque Sevin) dans des conditions non sécuritaires, laissa s’échapper dans l’atmosphère plus de 40 tonnes d’isocyanate de méthyle causant plus de 3500 décès immédiats par asphyxie et des milliers de victimes. Par la suite, les pesticides s’échappant des cuves de stockage abandonnées dans l’usine ont été lessivés pendant des années par les pluies et ont contaminé les nappes phréatiques et l’eau potable empoisonnant près de 300 000 indiens (cécité, invalidité, insuffisances respiratoires, avortements spontanés, malformations congénitales, etc.). À ce jour, le site n’a toujours pas été dépollué et des milliers de survivants continuent d’en souffrir. Pour en savoir plus : - Bhopal: 30 ans d’empoisonnement (Taillefer G., Le devoir, 2014) - Bhopal, l’infinie catastrophe (Bailly O., Le Monde Diplomatique, 2004) |
Pyréthrinoïdes
Les pyréthrinoïdes sont des dérivés synthétiques photostables des pyréthrines naturelles qui sont présentes dans les fleurs de chrysanthème (Chrysanthemum spp.) et de pyrèthre (Tanacetum cinerariifolium). Comme le DDT et ses analogues, ils perturbent la conduction nerveuse le long des axones principalement en prolongeant l’ouverture des canaux sodium dépendants du potentiel, ce qui provoque un afflux d’ions sodium dépolarisant le neurone et, de fait, une paralysie du système nerveux et des muscles. Toutefois, ils se lient au canal sodium sur un site différent de celui des diphényléthanes (DDT et dérivés).On distingue deux grands groupes de pyréthrinoïdes selon la structure chimique et les symptômes d’intoxication chez l’insecte :
- Les pyréthrinoïde de classe I (perméthrine, tétraméthrine, alléthrine) provoquent des tremblements et une hyperexcitabilité suivie d’une paralysie.
- Les pyréthrinoïdes de classe II (deltaméthrine, cyperméthrine, fenvalérate), qui possèdent un groupe alpha-cyané (CN), induisent une incoordination des mouvements de l’insecte qui conduit à sa paralysie; ceux-ci sont en général plus efficaces que les pyréthrinoïdes de classe I et nécessitent des doses moindres et des applications moins fréquentes.
À noter que chez les Diptères (mouches, moustiques), les pyéthrinoïdes induisent rapidement un effet de choc ou «knockdown» suivi d’une paralysie transitoire qui peut être réversible selon les doses.
L'activité insecticide des pyréthrinoïdes est habituellement augmentée par l'addition de pipéronyl butoxyde (PBO); ce synergiste inhibe les enzymes qui métabolisent les pyréthrinoïdes rendant ainsi les organismes visés plus sensibles.
Les pyréthrinoïdes agissent à très faibles doses surtout par contact. Ils peuvent aussi agir par ingestion, mais ils ne sont ni systémiques ni fumigants.
Développés dans les années 1970 pour remplacer les organochlorés et les organophosphorés, les pyréthrinoïdes sont en encore très utilisés de nos jours en agriculture, en horticulture, en lutte antivectorielle et en milieu domestique. Considérés comme inoffensifs pour l'humain, ils entrent dans la composition de nombreux biocides à usage domestique pour lutter contre les fourmis, les moustiques et les blattes (aérosols) ou encore à usage médical pour lutter contre les puces et les poux (lotions, shampoings). Certains d'entre eux comme la perméthrine et la deltaméthrine sont couramment appliqués sur les vêtements ou les moustiquaires pour se protéger des vecteurs.
Bien qu’ils soient plus stables que les pyréthrines naturelles, les pyréthrinoïdes sont dégradés assez facilement dans l'air par la lumière solaire. Par contre, ils peuvent être adsorbés par les sols et s'accumuler dans les sédiments et les eaux. Relativement peu toxiques pour les oiseaux et les mammifères, ils sont néanmoins très toxiques pour les poissons, les batraciens, les invertébrés aquatiques et les abeilles. Ils ne devraient être en aucun cas appliqués à proximité de plans d’eau. Par ailleurs, les pyréthrinoïdes induisent souvent des résistances chez les populations d'insectes visés et, ce faisant, deviennent de moins en moins efficaces.
Au niveau de la santé, les pyréthrinoïdes pourraient avoir des effets néfastes sur le développement du système nerveux chez les jeunes enfants. En particulier, une étude épidémiologique canadienne suggère un lien entre l'exposition aux pyréthrinoïdes, relevée par la présence de métabolites dans les urines, et certains troubles comportementaux chez l'enfant (Oulhote Y et Bouchard MF, Environnemental Health Perspectives 2013); la présence de métabolites dans 97 % des échantillons d'urine montre en outre que l'exposition domestique aux pyréthrinoïdes est très commune et que ceux-ci se dégradent assez lentement dans le corps.
Plus récemment, la deltaméthrine et ses résidus sont fortement suspectés de favoriser des troubles neurologiques (hyperactivité) et d’affecter le développement cognitif chez les jeunes enfants (Richardson et al., FASEB Journal 2015). En 2025, l’Agence nationale de sécurité sanitaire (Anses) alerte sur les risques associés aux insecticides pyréthrinoïdes pour leurs effets potentiels sur le neurodéveloppement des très jeunes enfants (troubles du comportement, anxiété, etc.), la reproduction (fertilité masculine) et certaines formes de cancer (leucémies) associées à une exposition proféssionnelle à la deltaméthrine (PestInfos, 2025).
Oxadiazines
Unique insecticide de la famille des oxadiazines à ce jour, l’indoxacarbe est un neurotoxique qui agit sur les mêmes canaux sodium dépendant du potentiel que le DDT et les pyréthrinoïdes, mais en ayant un effet inverse; contrairement à ces derniers qui causent l’ouverture prolongée des canaux sodium, cet insecticide bloque les canaux sodium en les maintenant fermés, ce qui interrompt la sortie des ions sodium (Na+) et, de ce fait, la conduction nerveuse. Autre différence, la molécule doit être activée par des enzymes dans le système digestif de l’insecte pour bloquer les canaux sodium.L’indoxacarbe est actif par ingestion ou contact surtout contre les larves de lépidoptères et est utilisé contre divers ravageurs (piérides, tordeuses, noctuelles, pyrales, cicadelles) sur les cultures légumières, les oléagineux et la vigne. On s’en sert aussi comme insecticide domestique contre les blattes et les fourmis dans les maisons ou encore contre les puces sur les chiens et les chats.
L’indoxicarbe est toxique pour les abeilles et les bourdons et ne doit pas être appliqué en leur présence (Anses, 2011).
Néonicotinoïdes et autres systémiques
Les néonicotinoïdes (imidacloprine, chlothianidine, thiaméthoxame), appelés plus communément «néonics», sont des composés synthétiques neurotoxiques dérivés de nitroguanidines ou de pyridylméthylamines. Comme la nicotine, un alcaloïde présent naturellement dans les feuilles de tabac, ce sont des agonistes du récepteur postsynaptique de l'acétylcholine de type nicotinique (nAchR), d’où leur nom; en s’y fixant, ils stimulent l’ouverture du canal cationique associé, ce qui provoque un afflux d’ions sodium et calcium qui dépolarise la membrane postsynaptique perturbant ainsi la conduction de l'influx nerveux. Efficaces à très faible doses, les néonicotinoïdes sont dotés d’une grande rapidité d’action et rémanence. Ce sont des insecticides systémiques qui sont absorbés par les racines ou les feuilles puis sont diffusés par le phloème dans l’ensemble de la plante, y compris le pollen et le nectar. Agissant soit par contact soit par ingestion, ils offrent une grande diversité de mode d’application et d’usages agricoles, domestiques ou vétérinaires :
- traitement préventif par enrobage des semences de soja, de maïs, de colza (canola) ou de tournesol
- traitement du sol contre les larves de doryphores ou de taupins ainsi que les vers blancs dans les pelouses
- pulvérisation foliaire sur différentes cultures maraîchères et fruitières contre les pucerons et les aleurodes (pomme de terres, légumes, petits fruits, plantes florales, arbres fruitiers)
- injection dans les troncs ou les charpentes contre les termites et les insectes xylophages
- en mélange avec des appâts contre les fourmis ou les blattes
- traitement topique des animaux contre les puces et colliers anti tiques
Relativement peu toxiques pour les humains à court terme (faible toxicité aiguë), les néonicotinoïdes présentent néanmoins une forte rémanence dans les sols et une forte écotoxicité. En particulier, ils ont une toxicité aiguë et chronique élevée pour les abeilles, les pollinisateurs sauvages, les insectes auxiliaires, les vers de terre (lombrics), les organismes aquatiques et, de ce fait, affecteraient l'ensemble de la faune insectivore comme les oiseaux. Ils restent encore actifs à très faibles doses, y compris à des doses indétectables, ce qui les rend encore plus dangereux pour les écosystèmes. À cause de l'accroissement des surfaces traitées et des périodes d'exposition, les néonicotinoïdes sont désormais présents dans les sols, les eaux de surface (rivières), l'air (lors de la période des semis) ainsi que dans les plantes cultivées, les adventices et les fleurs sauvages.
 |
| L'imidaclopride ou (2E)-1-[(6-chloro-3-pyridinyl)méthyle]-N-nitro-2-imidazolidinimine est l'ingrédient actif du Gaucho. Sa structure chimique n'est pas dérivée de la nicotine, mais il partage avec cette dernière un même mode d'action neurotoxique. Il est 1000 fois plus toxique pour les abeilles que le DDT. Crédit : Epop, travail personnel, licence Domaine public via Wikimedia Commons |
Les néonicotinoïdes sont très fortement suspectés d’être responsables, du moins en partie, du déclin actuel des populations d’abeilles et de pollinisateurs sauvages dans de nombreuses régions du monde notamment dans les pays industrialisés . À de faibles doses (non létales), ils peuvent nuire à leur capacité de butiner, de s'orienter et de se reproduire tout en affectant leur système immunitaire. Lorsqu'elles sont ainsi exposées via le butinage, les aérosols ou les flaques d'eau contaminées, les abeilles deviennent plus sensibles aux maladies et parasites et incapables de mener les tâches essentielles à la survie de leur colonie ce qui ralentit le développement et la productivité des colonies ou provoque leur effondrement (syndrome d'effondrement des colonies).
L'usage des semences traitées aux néonicotinoïdes est directement impliqué dans le déclin des populations d'abeilles et de pollinisateurs. Par exemple, au Canada, les semences traitées ont été mis en cause dans les fortes mortalités observées chez les abeilles pendant la période des semis de maïs grain au Québec et en Ontario (ARLA, 2012). De plus, elles favorisent le développement de la résistance des ravageurs aux néonicotinoïdes. Si les semences enrobées d'insecticides systémiques sont plus faciles à utiliser et plus sures pour les agriculteurs, des études, dont une réalisée au Québec sur le maïs grain (Labrie G et al., Rapport CÉROM et MAPAQ 2014), montrent que leur usage en traitement préventif n'augmentent pas de façon significative les rendements.
De fait, l'utilisation des néonicotinoïdes est de plus en plus contestée, particulièrement en Europe où l’imidacloprine (l'ingrédient actif du Gaucho®), la clothianidine et le thiamethoxame (l'ingrédient actif du Cruiser®) font l’objet d’une interdiction provisoire depuis 2013. En France, les néonicotinoïdes seront définitivement interdits à partir de septembre 2018.
Par ailleurs, les néonicotinoïdes pourraient aussi affecter le développement du système nerveux chez l'humain, notamment du cerveau (Kimura-Kuroda et al., PloS ONE 2012, EFSA 2015). Certains d'entre eux ont aussi des effets sur l'activité enzymatique des cellules humaines in-vitro en lien avec le développement de certains cancers du sein hormonaux dépendants chez la femme (Caron-Baudouin E et al., Toxicological Sciences 2016).
| The Task Force on Systemic Pesticides
TFSP Video (www.tfsp.info)
Une importante évaluation indépendante de la littérature scientifique mondiale menée par un groupe de chercheurs du monde entier (Task Force on Systemic Pesticides) a recensé les impacts négatifs directs et indirects des néonicotinoïdes et des insecticides systémiques : - sur les sols, les milieux aquatiques et les agrosystèmes (Bonmatin J-M et al., Environmental Science and Pollution Research, 2015.) - sur les invertébrés non ciblés comme les abeilles domestiques et sauvages, les papillons, les vers de terre (lombrics) et les invertébrés aquatiques (Pisa et al., Environmental Science and Pollution Research, 2015) - sur les vertébrés comme les oiseaux, les poissons, les amphibiens et les reptiles (Gibbons et al., Environmental Science and Pollution Research, 2015) - sur la dynamique des écosystèmes et des services offerts comme la pollinisation, le recyclage des nutriments et le contrôle naturel des parasites et ravageurs (Chagnon et al., Environmental Science and Pollution Research, 2015) Ces chercheurs préconisent la mise en place de mesures réglementaires plus strictes voire l’interdiction des néonicotinoïdes, notamment de leur usage préventif par enrobage des semences. Une étude scientifique réalisée aux Pays-Bas montre que les néonicotinoïdes ont aussi des effets indirects sur les populations d'oiseaux, ce qui pourrait mener vers un nouveau «printemps silencieux» (PestInfos, 2014). En 2017, deux nouvelles études réalisées à grande échelle, l'une en Europe sur des champs de colza (Woodcock et al., Science 2017), l'autre au Canada dans deux régions de maïsiculture (Tsvetkov et al, Science 2017), confirment les impacts globalement négatifs des néonicotinoïdes sur les populations d'abeilles domestiques et sauvages (espérance de vie, fertilité). En particulier, l'étude canadienne montre que les abeilles qui butinent les plantes en bordure des champs de maïs sont exposées à un cocktail de pesticides, dont des néonicotinoïdes. L'exposition à ces derniers réduit de 23% leur espérance de vie et altère leur efficacité à polliniser les plantes. |
Sulfoximides
Appartenant à la famille chimique des sulfoximines, le sulfoxaflor est un autre insecticide neurotoxique systémique dont le mode d'action est similaire à celui des néonicotinoïdes. Il bloque les récepteurs nAchR en se fixant sur un site d'action moléculaire différent de celui des néonicotinoïdes (Sparks et al., Pest Biochem Physiol 2013). Développé pour pallier aux résistances aux néonicotinoïdes, le sulfaxoflor est considéré par certains auteurs comme un "néonicotinoïde de quatrième génération" (Cutler et al., Pest Manag Sci 2013). Systémique, le sulfaxoflor est surtout utilisé pour lutter contre les insectes piqueurs suceurs comme les pucerons.Tout comme les néonicotinoïdes, le sulfoxaflor est très toxique pour les abeilles, mais est moins persistant que ces derniers. En septembre 2015, son homologation par l’EPA a été annulée par la plus importante cour d’appel fédérale des États-Unis en raison de preuves insuffisantes sur son innocuité sur les colonies d’abeilles (Reuters, 2015/09/10). Depuis, il a été homologué avec certaines restrictions d'usage pour "protéger les abeilles".
En Europe, où il est homologué depuis 2015, le sulfaxoflor suscite également de nombreuses controverses, en partie en raison du manque d'informations et d'études scientifiques sur son impact réel chez les abeilles et les pollinisateurs (Pollinis, 2015; UNAF, 2017).
Phénylpyrazoles
Le fipronil (l'ingrédient actif du Poncho®) appartient à la famille chimique des phénylpyrazoles. Tout comme le lindane et les cyclodiènes, cet insecticide et acaricide neurotoxique agit comme un antagoniste de l’acide gamma-aminobutyrique (GABA) en bloquant le canal chlore associé au récepteur GABA dans les synapses inhibitrices.Insecticide systémique à large spectre d’action, il est utilisé en agriculture contre divers ravageurs sur les grandes monocultures (blé, maïs, riz, coton, canne à sucre). Il est employé notamment en traitement préventif par enrobage des semences de maïs ou de tournesol. On l’emploie aussi en médecine vétérinaire pour lutter contre les puces, les tiques et les acariens responsables de la galle et comme insecticide domestique contre les fourmis, les blattes et les termites.
Comme les néonicotinoïdes, le fipronil présente une forte écotoxicité, particulièrement pour les abeilles et a suscité de nombreuses controverses en Europe dans les années 2000; il y est d’ailleurs interdit depuis 2013.
Diamides
Nouvelle famille d'insecticide découverte au début des années 2000, les diamides perturbent la contraction musculaire des insectes en inhibant les récepteurs de la ryanodine (RyR), un type de canaux calcium qui régule la libération de calcium intracellulaire stocké dans les fibres musculaires (Xu H et Sun Z, Mini Rev Med Chem 2018). Ces insecticides myocontractants provoquent une libération incontrôlée d’ions calcium (Ca++), ce qui paralyse les muscles de l’insecte et provoque sa mort. Il est à noter que les récepteurs RyR doivent leur nom à la ryanodine, un alcaloïde végétal utilisé comme insecticide, qui a permis de les caractériser et de les purifier. Contrairement à la ryanodine qui est aussi toxique pour les mammifères, les diamides ciblent sélectivement les canaux calciques RyR des insectes (Satelle et al, Invert Neurosci 2008). On distingue deux groupes chimiques :
- les diamides de l'acide phtalique comme le flubendiamide, le premier de ces nouveaux insecticides à avoir été commercialisé;
- les diamides anthraniliques ou anthranilamides comme le chlorantraniliprole (Rynaxypyr) et le cyantraniliprole (Cyazypyr), les deux principales matières actives commercialisées en Amérique du Nord et en Europe.
Comme les néonicotinoïdes, les diamides sont systémiques et peuvent être appliquées de trois façons différentes :
- par pulvérisation foliaire;
- par mouillage du sol;
- par enrobage des semences.
Plusieurs cas de résistance aux diamines ont été rapidement observés chez la Teigne des crucifères Plutella xylostella (Troczka et al, Neurotoxicology 2017), ce qui pourrait compromettre leur efficacité au champ et leur utilisation dans des stratégies de lutte contre la résistance aux néonicotinoïdes.
Contrairement au chlorantraniliprole et au flubendiamide, le cyantraniliprole et le cyclaniliprole présentent des risques aigus pour les abeilles et les autres arthropodes utiles, notamment lorsqu'ils sont appliqués sur le feuillage (Santé Canada 2013; Santé Canada 2017). Il est à noter que certaines préparations commerciales contiennent un mélange de cyclaniliprole et de thiaméthoxame, un néonicotinoïde. Une étude récente suggère que le chlorantraniliprole pourrait affecter le système immunitaire des abeilles (Christen et Fent, Environ Pollut 2017). Par ailleurs, le chlorantraniliprole peut nuire à la reproduction des oiseaux (Santé Canada 2016).
Les diamines sont extrêmement toxiques pour les invertébrés aquatiques d'eau douce et marins (EPA 2016; Cui et al, Chemosphere 2017). Très persistants dans les sols (y compris leurs produits de dégradation), ils peuvent se déplacer dans les sols et contaminer les eaux souterraines par lixiviation et les eaux de surface par ruisselement (Santé Canada 2013; Santé Canada 2017). Ils pourraient donc affecter les écosystèmes aquatiques.
Insecticides régulateurs de croissance (IRC)
Sur le marché, on trouve diverses molécules insecticides non neurotoxiques qui perturbent spécifiquement le cycle de développement des insectes principalement au cours des mues larvaires ou de métamorphose. Ce sont donc des larvicides qui agissent par ingestion. Plus sélectifs et généralement moins toxiques pour les vertébrés et les humains que les insecticides neurotoxiques, ces larvicides occupent encore une place limitée sur le marché mais sont de plus en plus utilisés en particulier dans les stratégies antirésistance. On en distingue trois grands types qui diffèrent par leur mode d’action :- les inhibiteurs de la biosynthèse de la chitine
- les mimétiques et analogues synthétiques de l’hormone juvénile
- les agonistes de l’ecdysone.
| Le contrôle hormonal des mues chez les Arthropodes Les mues sont des étapes essentielles du développement des Arthropodes notamment des insectes. Elles leur permettent de renouveler leur couche protectrice ou cuticule et d’accroître leur taille (mues larvaires) ou de se métamorphoser en nymphes (mue nymphale) ou en adulte (mue imaginale). Plusieurs hormones sont impliquées dans les mues soit les ecdysones, des hormones stéroïdes produites par les glandes prothoraciques, et les hormones juvéniles, des hormones sesquiterpénoïdes qui sont synthétisés dans des glandes proches du cerveau appelés corps allates. Les deux types d’hormones agissent en synergie : les ecdysones déclenchent les mues tandis les hormones juvéniles maintiennent les caractères larvaires de l’insecte; en d’autres mots, en l’absence d’hormone, juvénile, l’insecte se métamorphose en nymphe ou en adulte. |
Inhibiteurs de la biosynthèse de chitine
La chitine, un polysaccharide azoté formé par le polymérisation de N-acétylglucosamine, est l’un des constituants essentiels de la cuticule qui forme la couche externe protectrice et imperméable des arthropodes (Crustacées, Insectes, Arachnides, Collemboles). Plusieurs molécules inhibent les enzymes de la biosynthèse de la chitine au cours de la mue :- les benzoylurées (diflubenzuron, téflubenzuron, trifumuron, flufénoxuron)
- les polyoxines
- la buprofézine qui n’est active que sur les Homoptères (cicadelles, pucerons, cochenilles)
Les benzoylphénylurées sont les plus utilisés, entres autres, pour lutter contre les larves doryphore de la pomme de terre qui est de plus en plus résistant aux insecticides neurotoxiques. On les emploie aussi en lutte antivectorielle contre les larves de moustiques, en médecine vétérinaire contre les puces mais aussi en pisciculture contre les pous du saumon, des copépodes parasites (Crustacées). En particulier, l’utilisation du diflubenzuron dans les élevages de saumon en Norvège a suscité de vives polémiques en France dans les années 2010-2011. Il est aussi couramment employé dans les élevages de saumon atlantique au Canada.
Analogues et mimétiques synthétiques de l'hormone juvénile
Les analogues et mimétiques synthétiques des hormones juvéniles (méthoprène, pyriproxifène, fénoxycarbe) empêchent la métamorphose complète des larves d’insectes en adultes ce qui entraînent des malformations.Le méthoprène, un sesquiterpène complexe dont la structure chimique est très proche de celle de l’hormone juvénile (analogue structurel), est couramment utilisé en Amérique du Nord comme larvicide pour lutter contre les puces et les larves de moustiques en santé publique, les larves de mouches dans l’industrie agroalimentaire (viandes) mais aussi comme complément à d’autres insecticides pour limiter le développement de résistances. Actif à très faibles doses et très toxique pour certains invertébrés aquatiques, il est aussi considéré comme potentiellement cancérigène et perturbateur endocrinien. À noter que le méthoprène est considéré comme un biopesticide (pesticide biochimique) en Amérique du Nord.
Le pyriproxifène un dérivé de pyridines qui présente à la fois des effets larvicides et ovicides. Il est employé en agriculture contre les aleurodes et les cochenilles sur les arbres fruitiers, les cultures maraîchères sous serres et le coton, en lutte antivectorielle contre les moustiques et en médecine vétérinaire contre les puces et divers acariens parasites. Il est toxique pour de nombreux invertébrés aquatiques (crevettes, daphnies) et insectes auxiliaires de la lutte biologique, notamment des microhyménoptères parasitoïdes. En raison de son écotoxicité, il est interdit dans certains pays comme l'Allemagne et la Suisse. Utilisé au Brésil dans les réservoirs d'eau potable pour lutter contres les moustiques Aedes vecteurs du virus zika, il a récemment été soupçonné par des médecins sud-américains d'être impliqué dans l'explosion des cas de microcéphalies (Robinson C., GMWatch, Ecologist 2016). Il est toutefois l'un des larvicides recommandés par l'OMS pour lutter contre les moustiques vecteurs.
Le fénoxycarbe est un carbamate non neurotoxique qui agit comme un leurre hormonal (mimétique) et présente à la fois des effets larvicides et ovicides. On l’emploie entre autres contre les cochenilles et les aleurodes en maraichage et en viticulture. Il manifeste en outre une certaine toxicité pour les poissons et les abeilles et est suspecté d’être perturbateur endocrinien.
Agonistes de l'ecdysone
Les agonistes de l’ecdysone comme les benzhydrazides ou diacylhydrazines (tébufénozide, métoxyfénozide) se fixent spécifiquement sur les récepteurs nucléaires de l’hormone et déclenchent des mues prématurées chez les larves d’insectes. Ces larvicides sont surtout actifs contre les chenilles de Lépidoptères (noctuelles, teignes) et sont utilisés, entre autres, sur les arbres fruitiers, le riz et la vigne. Ils présentent l’intérêt d’être peu toxiques pour les insectes auxiliaires de la lutte biologique.Il est à noter que de nombreuses plantes synthétisent des molécules voisines de l’ecdysone probablement pour se défendre contre les ravageurs. Toutefois, ces phytoecdystéroïdes sont trop complexes à synthétiser ou à extraire des plantes.
Toxines bactériennes insecticides
De nombreuses bactéries produisent via leur métabolisme secondaire des substances toxiques (toxines) aux propriétés insecticides qui leur confèrent généralement un pouvoir entomopathogène. Parmi les toxines bactériennes qui sont employées comme insecticides, on trouve principalement les toxines de Bacillus thuringiensis et des lactones macrocycliques neurotoxiques (avermectines, spinosines).
Toxines Cry et Cyt de Bacillus thuringiensis
Le bacille de Thuringe (Bt), Bacillus thuringiensis (Bacillaceae), est une bactérie entomopathogène du sol qui est largement employée depuis les années 1950 comme auxiliaire de lutte biologique en agriculture, en foresterie (notamment en Amérique du Nord contre les épidémies de tordeuses et de spongieuses) et en santé publique (lutte antivectorielle et démoustication). Il en existe plusieurs souches qui sont pathogènes principalement pour les larves d'insectes de l'ordre des Lépidoptères (souche kurstaki ou Btk), des Diptères (souche israelensis ou Bti) et des Coléoptères (souche tenebrionis ou Btt). Lors de la sporulation, le Bt produit des inclusions cristallines contenant diverses endotoxines aux propriétés insecticides très spécifiques; celles-ci agissent par ingestion au niveau du tube digestif des larves d'insectes en perturbant la perméabilité ionique des cellules épithéliales et en provoquant leur lyse. On distingue deux grands types d'endotoxines qui diffèrent par leur structure moléculaire et leur mode d'action.
- les toxines cristallines Cry sont des protéines dont le poids moléculaire varie de 60 à 160 KDa et dont la structure comprend trois domaines distincts. Une fois dissoutes dans l'intestin, elles sont activées par des enzymes (protéases) par clivage de fragments peptidiques pour produire des toxines plus petites (de 30 à 60 KDa); les toxines ainsi activées se fixent sur des récepteurs de la membrane épithéliale puis s'y insèrent pour former des pores (Pardo-Lopez L et al., Microbiology Review 2013). À ce jour, on connaît plus de 700 protéines Cry différentes réparties en plus de soixante classes (Crickmore N., Bt Toxin Nomenclature 2016); chacune d'entre elle est toxique spécifiquement pour un petit nombre d'insectes cibles.
- Les toxines cytolytiques Cyt sont des protéines plus petites, dont le poids moléculaire est d'environ 30 KDa et qui n'ont pas besoin ni d'activation ni de récepteurs membranaires pour former des pores dans les membranes. Présentes chez un nombre restreint de souches, elles sont principalement actives contre des Diptères, notamment des moustiques et des mouches vecteurs. De plus, elles augmentent l’activité insecticide des toxines Cry. Une quarantaine de toxines Cyt ont été recensées à ce jour.
Non toxiques pour les humains et très spécifiques contre un nombre limité d'insectes, les biopesticides à base de Bt sont autorisés en agriculture biologique. Les formulations commerciales contiennent généralement un mélange de spores et de cristaux ou seulement des toxines encapsulées. Il est à noter que certaines souches peuvent être modifiées génétiquement pour moduler leur spectre d'action.
Depuis les années 1990, plusieurs plantes d'intérêt comme le maïs, le soja ou le coton ont été modifiées génétiquement par l'ajout d'un ou plusieurs gènes Cry pour résister à différents insectes ravageurs. Au cours des dernières années, la multiplication des surfaces cultivées avec des PGM-Bt (notamment du maïs-Bt en Amérique du Nord) a contribué au développement de résistances chez les insectes ciblés.
Selon certaines études, les toxines Cry produites les PGM-Bt pourraient s'accumuler dans les sols et les rivières drainant les zones de grandes cultures au point à poser des problèmes à différents invertébrés aquatiques (Rosi-Marshall et al, PNAS, 2007).
Lactones macrocycliques neurotoxiques
Les lactones macrocyliques (LM) regroupent différentes molécules complexes synthétisées naturellement par des bactéries du sol. On distingue deux familles de neurotoxines insecticides soit les avermectines et les spinosines.
Avermectines
Les avermectines (abamectine, ivermectine) sont produites par des bactéries Actinomycètes du genre Streptomyces (S. avermitilis). Elles regroupent à la fois des composés naturels (abamectine, ivermectine) et des composés hémisynthétiques (émamectine benzoate). Les avermectines sont dotées de propriétés insecticides, acaricides et nématicides.Ces neurotoxines bloquent la conduction de l’influx nerveux et la contraction musculaire en se liant aux canaux chlore glutamate dépendant (GluCl), ce qui augmente la conductance de la membrane au chlore et provoque une décontraction musculaire irréversible. Chez les Arthropodes et aux doses élevées, elles affecteraient aussi les canaux chlore associés aux récepteurs de l’acide gamma –amminobutyrique (GABA) au niveau des terminaisons nerveuses ou des jonctions neuromusculaires des synapses inhibitrices.
En phytoprotection, les avermectines sont employées, entre autres, contre les acariens, les mouches mineuses et les chenilles de Lépidoptères (carpocapses, tordeuses) sur les cultures légumières, les arbres fruitiers et la vigne. Elles agissent par ingestion et possèdent un mode de pénétration dans la plante qualifié de «trans-laminaire»; en d'autres mots, elles pénètrent dans les feuilles mais sans être véhiculées dans l'ensemble de la plante. À noter que les avermectines naturelles comme l'abamectine sont autorisées en agriculture biologique.
On emploie aussi les avermectines comme insecticides domestiques, par exemple en mélange dans des appâts pour lutter contre les fourmis. Toutefois, elles servent surtout en médecine humaine et vétérinaire comme médicament antiparasitaire et vermifuge contre divers endoparasites et ectoparasites : les vers nématodes responsables de filarioses, les acariens endoparasites comme le sarcopte (Sarcoptes scabiei) qui cause la gale ou ectoparasites hématophages comme les tiques, les copépodes ectoparasites des poissons comme les poux du saumon. Ce faisant, elles sont très employés en élevage et en pisciculture.
| En 2015, William C. Campbell et Satoshi Ōmura ont obtenu le prix Nobel de Physiologie et de médecine pour leurs travaux sur l'ivermectine qui ont permis d'élaborer un traitement de l'onchocercose (cécité des rivières) et de la filariose Lymphatique, deux maladies parasitaires tropicales dues à des nématodes transmis par des moustiques. |
Ces insecticides sont toxiques pour les insectes utiles et les organismes aquatiques. Très employés pour vermifuger les bovins et les chevaux, les avermectines et leurs métabolites se retrouvent après plusieurs mois dans les matières fécales à des concentrations toxiques pour les insectes coprophages comme les bousiers (Coléoptères : Aphodius constans) et les larves de Diptères (Neomyia cornicina, Scathophaga stercoraria); elles affecteraient indirectement divers mammifères insectivores (hérissons, musaraignes, blaireaux, chauves-souris) qui les consomment (Mc Cracken D.I, Veterinary Parasitology 1993, Lumaret JP et al., Current Pharmaceutical Biotechnology 2012).
Apparentées aux avermectines, les mylbémycines (mylbémycine oxime) sont beaucoup plus efficaces et sont exclusivement utilisée en médecine vétérinaire.
Spinosines (Spinosad)
Les spinosines (ou spinosynes) sont des neurotoxines produites par fermentation d’une autre bactérie Actinomycète (Saccharopolyspora spinosa) présente dans le sol. Leur mode d’action neurotoxique est semblable à celui des néonicotinoïdes qui affectent les récepteurs nictotiniques de l’acétylcholine (nAchR). Non systémiques, elles agissent principalement par ingestion. Le Spinosad, qui est composé de spinosines A et D, est un larvicide très efficace contre les chenilles de divers Lépidoptères (pyrale du maïs, tordeuses, spongieuses, pyrales, processionnaire du pin, carpocapse des pommes et des poires), les thrips et les pupes de certains Diptères comme la mouche de l’olive. Bien qu’il soit autorisé en agriculture biologique, le Spinosad est toxique pour les abeilles, certains parasitoïdes auxiliaires, notamment des hyménoptères (Biondi A. et al., Pest Management Science 2012) ainsi que pour la faune aquatique. Il doit donc être utilisé avec précaution afin de minimiser, d’une part, les effets non intentionnels sur les auxiliaires et, d’autre part, les risques d’apparition de résistance (AgriRéseau, 2007).
Insecticides phytochimiques
Pour se protéger contre les insectes herbivores, de nombreuses plantes synthétisent naturellement des métabolites secondaires (alcaloïdes, flavonoïdes, terpénoïdes, etc.) qui présentent des effets insecticides, acaricides, anti-appétants ou répulsifs. On connaît à ce jour plus de 2000 plantes aux propriétés insecticides ou insectifuges. Certains d'entre eux comme les pyréthrines sont employés comme insecticides ou insectifuges naturels depuis l'Antiquité et comme précurseurs de nouvelles familles de pesticides de synthèse, depuis l'avènement de la chimie organique.
Les insecticides phytochimiques présentent l'avantage d'être facilement dégradables dans l'environnement par les facteurs physiques ou la microflore du sol, ce qui limite leurs résidus. Toutefois, plusieurs d'entre eux, comme la nicotine ou la ryanodine, peuvent être aussi toxiques pour la faune, les pollinisateurs et les humains. D'autres comme les pyréthrines peuvent aussi induire des résistances chez les populations d'insectes ciblées. De fait, un usage mal approprié de ces composés peut s’avérer aussi dangereux pour l’utilisateur ou l’environnement que l’usage de produits chimiques de synthèse.
Pyréthrines naturelles
La poudre de fleurs séchées de pyrèthre de Dalmatie (Chrysanthemum cinerariaefolium, Astéracée) et d’autres chrysanthèmes est connue depuis l’Antiquité pour ses propriétés insecticides et acaricides. En Perse et en Chine, on s’en servait, entre autres, pour se débarrasser des poux. La poudre insecticide contient en effet six composés neurotoxiques, les pyréthrines (pyréthrines I et II, Jasmonines I et II, Cinérines I et II) qui agissent par contact sur les insectes en inhibant la repolarisation des canaux sodiques et en provoquant une paralysie rapide («knocdown»). À noter que les insectes peuvent se remettre de ce choc après quelques heures seulement. |
| Une fois séchées, les capitules du pyrèthre de Dalmatie (Chrysanthemum cinerariaefolium, Astéracée) sont réduites en poudre afin d'en extraire par raffinage les pyréthrines qui en constituent de 0,9 à 1,3 % en poids. Le Pyrèthre de Dalmatie est principalement cultivé au Kenya et en Tanzanie pour la production des pyréthrines. Il peut aussi croître sous des climats plus tempérés et on peut s'en servir pour fabriquer soi-même une poudre insecticide «maison» pour les besoins d'un petit potager (Duval J., eap.mcgill.ca 1993). Crédit photo : Roger Culos - travail personnel, licence CC BY-SA 3.0 |
Très instables à la lumière, biodégradables et modérément toxiques pour les humains, les oiseaux, et les abeilles, les pyréthrines sont surtout employées, sous forme de poudre ou de liquides (savons ou huiles), dans les maisons, les jardins et les potagers pour lutter contre les pucerons, les chenilles, les mouches, les fourmis, les guêpes et les acariens. On les emploi aussi pour désinsectiser les locaux de stockages et le matériel de transport et pour traiter les animaux domestiques et le bétail contre les poux et tiques. Elles entrent aussi dans la composition de produits anti-poux à usage médical.
Peu sélectives, les pyréthrines sont toutefois très toxiques pour les poissons et organismes aquatiques et pour un grand nombre d’insectes bénéfiques.
La recherche de dérivés plus stables a conduit au développement des pyréthrinoïdes de synthèse. Comme ces derniers, les pyréthrines naturelles peuvent induire des résistances chez les insectes ciblés.
Alcaloïdes insecticides (nicotine, ryanodine)
Les alcaloïdes sont des hétérocycles azotés principalement synthétisés à partir des acides aminés par les végétaux. Sous forme purifiée, ces molécules présentent souvent divers effets toxiques. Les principaux alcaloïdes insecticides sont la nicotine et la ryanodine.
Nicotine
La nicotine est un alcaloïde neurotoxique produit dans les feuilles du tabac (Nicotiana tabacum) et d’autres Solanacées. Agoniste de certains récepteurs de l’acétylcholine (les récepteurs nicotiniques), elle perturbe le fonctionnement des jonctions neuromusculaires. Ce puissant insecticide et acaricide systémique a longtemps été utilisé pour lutter contre certains insectes piqueurs suceurs, notamment sur les plantes vivrières, mais son usage est désormais interdit dans la plupart des pays en raison de sa très grande toxicité pour les humains et les mammifères (elle est 50 fois plus toxique que le DDT). Des jus de nicotine obtenus par macération de mégots dans l’eau sont parfois utilisés artisanalement dans les jardins; cet usage peut cependant s’avérer très dangereux pour l’utilisateur et la faune.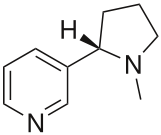 |
| Structure chimique du (S)-3-(1-méthyl-2-pyrrolidinyl )pyridine ou nicotine Les néonicotinoïdes ont une structure différente de la nicotine mais partagent un même mode d'action, d'où leur nom. Crédit : Harbin - travail personnel, licence Domaine public via Wikimédia Commons |
D’autres alcaloïdes proches de la nicotine comme l’anabasine, la nornicotine ou la vératridine (Veratrum album, Liliaceae) ont aussi été utilisés par le passé comme insecticides et acaricides. En Chine, l’acotine (Aconitum spp., Renonculaceae) sert à protéger les semences des ravageurs, notamment des rongeurs. Des études récentes ont montré que l’anabasine, présente dans le nectar des fleurs, protège les bourdons et les abeilles sauvages contre certains parasites intestinaux sans autres effets négatifs qu’un retard de la ponte (Anthony WE et al, PLoS One 2015).
Ryanodine
Extrait d’une plante d’Amérique centrale, Ryania speciosa (Liliaceae), la ryanodine est un alcaloïde neurotoxique qui perturbe le fonctionnement de canaux calcium présents dans les neurones et les muscles des insectes. Aux États-Unis, elle est utilisée comme insecticide contre les tordeuses, les carpocapses, la pyrale du maïs et les thrips des agrumes. Sa toxicité pour les humains et les mammifères limite son utilisation.
Roténone
La roténone est un flavonoïde produit par les racines, feuilles et tiges de plusieurs plantes légumineuses tropicales (Lonchocarpus spp., Paraderris spp., Derris spp., Fabaceae). Toxique pour de nombreux animaux poïkilothermes, en particulier les poissons, les batraciens et les insectes, elle agit en inhibant le transport des électrons dans la respiration cellulaire au niveau des mitochondries. Traditionnellement utilisée par les autochtones pour la pêche dans certains pays d’Amérique du Sud, la roténone a aussi été massivement utilisée en Europe comme insecticide de contact jusque dans les années 1940.Dans les années 1990-2000, elle a connu un regain d’intérêt en agriculture biologique, particulièrement en arboriculture pour lutter contre les pucerons, teignes et mouches des fruits mais aussi dans la lutte contre le doryphore de la pomme de terre. Toutefois, des études récentes ont montré qu’une exposition chronique (à des doses faibles et répétées) à la roténone pourrait induire la maladie de Parkinson, une maladie neurodégénérative, chez les humains (Tanner et al., Environmental Health Perspectives 2011). Son usage comme insecticide est désormais interdit en Europe et au Canada.
Il est à noter qu'au Québec, on emploie aussi la roténone dans les lacs, étangs et bassins aquacoles comme piscicide pour éliminer les poissons envahissants ou indésirables et pour restaurer certaines espèces d’intérêt commercial.
Quassine
Extraite du bois de Quassia amara (Simaroubaceae), un arbre tropical originaire d’Amérique du Sud, et connue pour son amertume, ses vertus médicinales et toniques, la quassine est un triterpène cyclique qui présente des propriétés insecticides et insectifuges intéressantes. Au 19e siècle, elle fut utilisée dans la fabrication des papiers tue-mouche. Des préparations à base d’écorce macérée dans l’eau et de savon noir étaient aussi employées comme insecticide contre les pucerons. De nos jours, elle est surtout employée comme dénaturant des alcools industriels et dans certains produits cosmétiques.Testée à grande échelle en Europe et commercialisée dans certains pays dont la Suisse, la quassine, qui est systémique, s’est montrée efficace sur les pucerons, les hoplocampes (Tenthredinidae) et d'autres insectes suceurs des arbres fruitiers et des plantes ornementales (Ondet SJ., AlterAgri 2003). Des études antérieures montrent aussi des effets insecticides et anti-appétants sur les larves du criquet migrateur africain et les larves de moustiques.
Toutefois, un manque de données toxicologiques et des doutes quant à son innocuité sur la santé pourraient compromettre son homologation en agriculture biologique.
Huile de neem (azadirachtine)
Extraite des graines du margousier ou neem (Azadirachta indica, Méliacae), l'huile de neem présente des propriétés insecticides, insectifuges, acaricides, antiparasitaires, fongicides et biostimulantes. Elle est utilisée traditionnellement par les agriculteurs indiens comme insecticide et fertilisant.Obtenue par pression à froid des graines, l’huile de neem est composée d’un mélange d’une centaine de molécules dont le principal ingrédient actif serait l’azadirachtine, un terpénoïde complexe de la famille des limonoïdes. Son mode d’action exact reste encore controversé, mais elle agirait sur les arthropodes surtout comme un régulateur de croissance en inhibant la mue des larves et la ponte chez les femelles. Systémique, elle exerce aussi des effets répulsifs et anti apétants qui protègent les plantes contre les infestations et les attaques de ravageurs.
 |
| Structure chimique de l'azadirachtine, principal ingrédient actif de l'huile de neem Crédit : Edgar181 - travail personnel, licence Domain public via Wikimedia commons |
L’azadirachtine et l’huile de neem se sont avérés efficaces pour contrôler plus de 400 espèces d’insectes et d’acariens, plusieurs nématodes et parasites mais aussi pour prévenir plusieurs maladies fongiques (Bélanger A. et Musabyimana T., Journées horticoles 2005 via AgriRéseau). Hydrosoluble, l’huile de neem peut être facilement diluée dans l’eau afin d’être pulvérisée sur les cultures, dans les maisons et dans les étables.
En Amérique du Nord, au Brésil et, dans une moindre mesure en Europe, plusieurs biopesticides à base d’huile de neem ou d’azadirachtine sont désormais disponibles sur le marché. Ce sont les biopesticides botaniques les plus utilisés dans le monde actuellement. Leurs applications insecticides et acaricides sont très diverses :
- en agriculture et horticulture contre divers ravageurs tels les pucerons, les thrips, les aleurodes, les cochenilles, les tétranyques et les chenilles de lépidoptères sur les plantes ornementales, les pommiers, la pomme de terre et les cultures légumières;
- en sylviculture et dans les parcs urbains contre plusieurs insectes xylophages et défoliateurs dont la spongieuse, la livrée des forêts et la tordeuse du bourgeon de l’épinette. En particulier, au Canada, l’azadirachtine (TreeAzin, BioForest technologies inc.) est injectée directement dans les troncs des frênes, sous l’écorce, pour prévenir les attaques de l’agrile du frêne (Ressources naturelles Canada 2013);
- en santé humaine et animale contre les moustiques, les mouches, les puces et les tiques dans les maisons, les étables et sur le bétail; elle est utilisée, entre autres, dans des lotions ou savons anti-poux et dans certains produits ménagers anti-acariens destinés à éliminer les acariens des poussières des tapis ou matelas.
Bien qu'elle soit homologuée comme biopesticide dans plusieurs pays dont les États-unis, le Canada, le Brésil ou l'Australie, l’huile de neem est interdite d’utilisation pour un usage phytosanitaire en France et en Europe. Elle y est suspectée d'être un perturbateur endocrinien. En France, son usage comme insecticide domestique ou fertilisant (engrais) est néanmoins autorisé.
Bien qu'elle n'est pas toxique pour les abeilles adultes (butineuses), l'huile de neem induit des troubles de la métamorphose chez les larves entrainant des malformations chez les jeunes abeilles. Son utilisation comme acaricide en apiculture contre la varroose des abeilles est donc à proscrire.
Huiles et acides gras végétaux
Les acides gras et les huiles (esters d'acides gras) sont connus pour exercer une action insecticide sur un large spectre d’insectes au corps mou (pucerons, cochenilles, thrips). Ces liquides visqueux très lipophiles agissent surtout par contact direct en formant un film huileux qui asphyxie les insectes et qui détruit la couche cireuse de leur cuticule entraînant leur déshydratation. Facilement biodégradables, généralement très peu toxiques pour les humains et la faune, les huiles et acides gras peuvent toutefois être toxiques pour certaines plantes (généralement à des concentrations supérieures à 2 %).Plusieurs huiles végétales sont particulièrement efficaces contre les pucerons et les acariens sur différents types de culture, notamment dans les vergers, les cultures légumières et sur les plantes ornementales. On peut les appliquer seules en solution à 2 % maximum sur les plaies des arbres infectés ou, le plus souvent, émulsionnées avec un surfactant (savon) afin de les pulvériser sur les ravageurs. Parmi les huiles végétales les plus utilisées comme insecticides, on peut citer :
- l'huile de graines de neem (margousier)
- l'huile de soja (soya) qui est aussi efficace comme insectifuge pour éloigner les moustiques
- l'huile de colza (canola)
- l'huile d'ail qui contient aussi divers composés soufrés aux propriétés antifongiques et antimicrobiennes
- l'huile de graines de coton
- l'huile d'arachide qui sert surtout d'insectifuge traditionnel dans les pays tropicaux.
Il est à noter que les huiles minérales (paraffines) servent aussi couramment d'insecticides en horticulture et arboriculture (en traitement d'hiver).
Sur le marché, on trouve aussi des savons insecticides qui sont obtenus par mélange d'acides gras d'origine végétale ou animale avec une base forte comme l'hydroxyde de potassium (KOH) ou l'hydroxyde de sodium (NaOH). Comme les huiles, ces sels d'acides gras agissent sur les arthropodes par contact en modifiant la perméabilité de la cuticule, ce qui entraîne leur déshydratation. On les emploie surtout sur les plantes ornementales, aussi bien à l’intérieur qu’à l’extérieur. Facilement biodégradables, généralement peu toxiques pour la faune, les savons insecticides peuvent toutefois être toxiques pour certaines plantes; certains sont d'ailleurs employés comme herbicides.
Il est à noter que des recettes d'insecticides maisons peuvent être facilement préparées à partir de savon noir ou d'huiles alimentaires pour un usage domestique ou à l'échelle d'un jardin; il suffit de diluer du savon liquide à 5 % ou de l'huile à 2 % avec de l'eau de pluie ou de source et de pulvériser la préparation sur le feuillage des plantes.
Huiles essentielles
Les huiles essentielles de nombreuses plantes telles que l’ail, la menthe, le thym, le giroflier, les agrumes, la lavande, la citronnelle, l’eucalyptus, le pin, le cèdre, le thé des bois, la cannelle, le romarin, la sauge, le basilic, etc. sont connues pour leur action insecticide, acaricide et répulsive. Généralement extraites par entraînement à la vapeur, ces huiles essentielles sont composées d’un mélange complexe de 10 à 50 métabolites secondaires volatils, principalement des terpénoïdes (monoterpènes : thymol, menthol, géraniol, linalol, limonène, etc.) et dans une moindre mesure des phénylpropanoïdes (aldéhyde cinnamique, eugénol, méthyl-eugénol). Parmi les composés les plus actifs contre les insectes et les acariens, on trouve :- le thymol extrait du thym
- l'eugénol extrait du clou de girofle
- la pulégone extrait de la menthe pouliot ou de la menthe poivrée
- l'aldéhyde cinnamique extrait de la cannelle
- le R-limonène extrait de l'orange douce ou du citron (qui possède aussi des effets fongicides)
- divers monoterpènes extraits de la fausse ambroisie (Chenopodium ambrosioides)
Volatiles et lipophiles, les huiles essentielles sont toxiques pour les insectes et acariens par inhalation (fumigation) ou par contact direct. Outre des effets répulsifs et anti-appétants, elles ont l'avantage d'avoir des modes d'action multiples à la fois physiologiques et physiques (Chiasson H. et Beloin N., Antennae 2007) :
- effets physiologiques en perturbant la croissance, la mue, la ponte ou la reproduction des insectes. Selon certains auteurs, les terpènes des huiles essentielles pourraient aussi agir sur les récepteurs de l’octopamine, un neuromédiateur impliqué, entre autres, dans la régulation des contractions musculaires des arthropodes.
- effets physiques par contact direct en dégradant la couche externe cireuse de la cuticule des insectes et acariens à corps mou, ce qui provoque leur déshydratation, ou en les asphyxiant en bouchant les trachées respiratoires.
Plusieurs biopesticides à base d’huile essentielle sont disponibles sur le marché nord-américain, notamment pour protéger les denrées alimentaires stockées contre les infestations d'insectes et d'acariens et pour éliminer les ectoparasites du bétail.
Des répulsifs et insectifuges à base d’huile essentielle d’eucalyptus citronné (p-menthane 3,8-diol), de citronnelle (citral) ou de lavande (linalol) sont aussi disponibles pour se protéger contre les piqûre des moustiques, mouches et tiques.
Insecticides inorganiques et minéraux
Si les insecticides inorganiques et minéraux ont autrefois été très utilisés, ils n’occupent plus qu’une place limitée sur le marché. En particulier, les arséniates de plomb, qui sont très persistants dans les sols et hautement toxiques pour la faune, sont désormais interdits dans la plupart des pays et ont été remplacés par des pesticides organiques de synthèse.Phosphine
La phosphine est un gaz d’hydrure de phosphore (PH3) employé comme agent de fumigation pour traiter les semences et les denrées stockées contre tous les stades de développement des insectes et acariens ravageurs. On s’en sert aussi comme rodenticide et taupicide. Le gaz peut être soit appliqué directement sur les semences ou sur les structures (silos et cales à grains) soit être produit au moment du traitement lorsqu’une pastille de phosphure métallique d’aluminium ou de magnésium entre en contact avec l’eau de l’air. Des adjuvants sont nécessaires pour limiter l’inflammabilité du gaz au contact de l’air.La phosphine perturbe la synthèse des protéines et les enzymes impliqués dans la respiration cellulaire. Très toxique par inhalation pour les humains, la phosphine et les phosphures métalliques doivent être manipulés avec une extrême prudence et uniquement par des spécialistes munis d’un équipement de protection adéquat. Le gaz ne laisse pas de résidus sur les produits traités. Toutefois, plusieurs insectes ravageurs des denrées stockées ont développé des résistances à la phosphine.
Insecticides minéraux naturels
Quelques produits minéraux naturels ont un faible impact sur l’environnement et la santé et sont commercialisés pour un usage domestique et agricole, notamment en agriculture biologique. Voici les plus populaires.
Borax
Le borax est un minéral alcalin de tétraborate de sodium (Na2B4O7•10H2O) que l’on trouve naturellement sous forme de minerai. Il présente, entre autres, des propriétés détergentes, désinfectantes, insecticides et acaricides. On l’utilise principalement comme insecticide domestique, sous forme de poudre, mélangée à des appâts, ou sous forme de savons liquides, pour lutter contre les insectes rampants comme les blattes et les fourmis. Dilué à l’eau, on l’emploie aussi pour préserver le bois et les charpentes des insectes xylophages. Le borax agit par ingestion en détruisant progressivement (en quelques jours) le système digestif des insectes. Il est particulièrement efficace pour détruire les colonies de fourmis qui, après l’avoir ingéré, le ramènent au nid et le partagent avec leurs congénères. Le borax est peu toxique pour les humains, sauf à dose élevée. Il est à noter que le borax possède aussi une certaine activité herbicide. On l'emploie aussi comme engrais pour les plantes souffrant d'une carence en bore. |
| Cristaux de tétraborate de sodium (borax) Crédit photo : Rock Currier, licence CC BY 3.0 via Wikimédia Commons |
L’acide borique (B(OH3)) est employé comme antiseptique, insecticide et fongicide. L’acide borique, qui est présent à l’état naturel dans certaines fumerolles, est le plus souvent produit par réaction du borax avec de l’acide sulfurique.
Terre de diatomées
La terre de diatomées est une poudre de dioxyde de silicium (SiO2) obtenue par broyage de diatomite, une roche constituée par les «squelettes» de diatomées. Souvent mélangée à un appât, elle est surtout employée comme insecticide domestique contre les insectes rampants (fourmis, blattes); très coupants, les cristaux de silice agissent par contact en perforant la cuticule des insectes qui se déshydratent et meurent en quelques jours. On s’en sert aussi dans les jardins et potagers pour lutter contre les limaces ou les doryphores de la pomme de terre et dans l'industrie agroalimentaire pour protéger les denrées stockées, notamment les grains, contre les ravageurs.Lorsqu'on applique de la terre de diatomées, il faut éviter de respirer les poussières de silice. Une exposition chronique aux poussières de silice peut en effet provoquer des maladies pulmonaires graves comme la silicose.
Kaolin
Le kaolin est une une argile composée de silicates d’aluminium (Al2SiO5). On l'emploie pour repousser les ravageurs (tordeuses, cicadelles, pyrales, psylles, pucerons) dans les vergers; pulvérisé sur les arbres fruitiers sous forme de poudre, le minéral forme une fine barrière mécanique non toxique qui repousse les ravageurs et gène leur système de reconnaissance. Le kaolin est largement employé en arboriculture biologique aux États-Unis et, dans une moindre mesure, en France. |
| Dans une orangeraie (États-Unis), le feuillage des arbres est protégé par un film de kaolin. Crédit photo : USDA ARS Photo Unit, USDA Agricultural Research Service, Bugwood.org |
Huiles minérales
Les huiles minérales, appelées aussi «huiles de dormance», «huiles horticoles» ou «huiles blanches» sont utilisées régulièrement sur les arbres et arbustes en dormance pour lutter contre divers ravageurs en hibernation (acariens, pucerons, cochenilles, aleurodes) et, dans une moindre mesure, contre les maladies cryptogamiques. Ces huiles en solution à 2 %, qui sont émulsionnées avec un surfactant (savon), agissent par contact en détruisant la cuticule des insectes hibernants et en les asphyxiant. On les utilise dans les cultures ornementales, aussi bien à l’extérieur qu’en serres, en arboriculture, dans les vignes et les vergers (oliveraies, bananeraies, orangeraies). Les huiles minérales sont biodégradables et sont peu toxiques pour les humains, les oiseaux et les poissons. Par contre, elles sont peu sélectives et peuvent donc tuer un grand nombre d’insectes non ciblés (auxiliaires, pollinisateurs). Au moment du traitement qui doit se faire exclusivement l'hiver, peu d'insectes auxiliaires sont toutefois présents sur les arbres. Elles sont aussi phytotoxiques pour certains arbres comme les érables et les noyers. Comme toutes les huiles insecticides, elles ne doivent pas être utilisées à des concentrations supérieures à 2 % (Duval J., eap.mcgill.ca 1994).
Il est à noter que les huiles minérales (paraffines) ne sont pas des composés inorganiques; constituées d'alcanes (CnH2n+2), elles sont obtenues par distillation du pétrole ou extraites de la tourbe, deux matières organiques fossilisées, essentiellement d'origine végétale.
Acaricides
Les acaricides sont destinées à lutter contre :- les acariens phytophages (tétranyques)
- les Varrora qui parasitent les abeilles
- les acariens des poussières dont les débris et déjections peuvent causer des allergies
- les acariens ectoparasites hématophages de vertébrés (tiques, aoutats) qui peuvent transmettre des maladies
- les acariens endoparasites qui creusent des galeries dans l'épiderme des mammifères et causent la gale (Sarcoptes scabiei).
Les acaricides présentent une grande diversité de structure chimique (Alan Wood, Compendium of Pesticide Common Names, Acaricides, 2014) et de modes d'action (IRAC, Acaricide Mode of Action Classification, 2014).
Insecticides acaricides
Les acariens (Arachnides) étant des Arthropodes très proches des Insectes, la plupart des insecticides ont une activité acaricide. Certains insecticides sont particulièrement efficaces contre les acariens :- organochlorés : DDT, endosulfan
- organophosphorés : pyrimiphos-méthyl
- carbamates : méthomyl
- pyrérhrinoïdes : bifenthrine, fenpropathrine, fenvalerate
- phénylpyrazoles : fipronil
- benzoylurées :
- avermectines : ivermectine
- formamidines : amitraze, chlordimeform
Acaricides spécifiques
Il existe aussi plusieurs acaricides spécifiques qui sont inactifs ou peu actifs contre les insectes. De nos jours, ceux-ci sont de moins en moins employés au profit des insecticides à plus large spectre d'action, notamment en agriculture. Certains d'entre eux comme l'aide formique peuvent néanmoins être intéressants pour lutter contre la varroose (varroase) des abeilles en apiculture.Carbinols
Les carbinols sont des composés chlorés (dicofol, chloropropylate) ou bromés (bromopropylate) dont la structure qui comprend un diphényl est proche de celle du DDT. Ils sont utilisés contre les tétranyques sur les arbres fruitiers, les cultures légumières et la vigne.Sulfones et sulfonates
Les sulfones et sulfonates (chlorofénizon) sont des composés organiques dont la structure chimique comprend au moins un atome de soufre. Ils sont peu toxiques.Acaricides organostanniques
Les acaricides organostanniques (cyhexatin, fenbutatin oxyde, azocyclotin), dont la structure comprend au moins un atone d'étain (Sn), bloquent la respiration cellulaire des acariens en inhibant la synthèse de l'ATP mitochondrial. L'azocyclotin est un acaricide à longue durée qui sert à lutter contre les tétranyques. Très lipophiles, ils sont toxiques pour l'environnement et la santé.Acide formique
L’acide formique ou méthanoïque, qui est présent naturellement dans les glandes des abeilles et des fourmis, les poils des orties (Urticaceae) et les fruits de diverses plantes, est un acaricide efficace en apiculture pour lutter contre le varroa, un acarien ectoparasite des abeilles. On l’applique en imbibant une éponge ou un tampon avec une solution à 65 %, placés à la base des ruches; ses émanations gazeuses agissent par contact sur les acariens sans importuner les abeilles. Il faut toutefois l’utiliser avec prudence pour éviter de tuer les reines (Hanley A. et Duval J., eap.mcgill.ca 1995). L’acide formique disponible sur le marché est obtenu de façon synthétique à partir du monoxyde de carbone. Il est néanmoins généralement autorisé en apiculture biologique. |
| Lutte chimique contre le varroa. Crédit photo : Florida Division of Plant Industry , Florida Department of Agriculture and Consumer Services, Bugwood.org, licence CC BY 3.0 US |
Olivier Peyronnet
Dernière mise à jour : septembre 2018 (décembre 2025)






Aucun commentaire:
Publier un commentaire